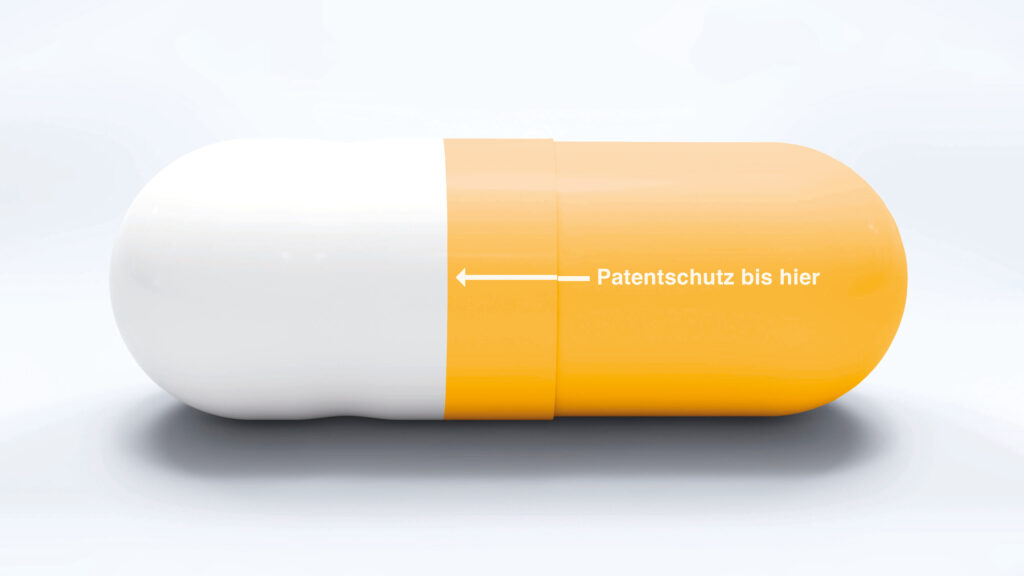
20 Jahre gilt der Patentschutz für ein Medikament. Das ist anders als etwa im Markenrecht, wo der Schutz für eine angemeldete Marke keiner zeitlichen Begrenzung unterliegt. Bis es zu einer Anmeldung kommt, hat ein Unternehmen schon einen langen und extrem kostspieligen Weg zurückgelegt. Wobei sich schon die Frage stellt, was letztlich der korrekte Preis für das Produkt Medikament ist. Verschiedene Optionen nennt Dr. Anna-Kristine Wipper, Partnerin und Head of IP-Law bei der KPMG Law Rechtsanwaltsgesellschaft: „Wenn es sich um ein lebenserhaltendes Medikament handelt, ist dann der Preis ausschlaggebend, den ein Menschenleben hätte? Aber wo liegt dieser? Oder ist der Forschungsaufwand ausschlaggebend? Und wenn wir das weiterdenken – zählt nur der Forschungsaufwand für das eine Medikament, der in Patentanmeldung und Zulassung mündet? Es ließen sich ja auch die Kosten für jede weitere Forschung, die nicht zu diesem Ergebnis gekommen ist, berücksichtigen. Oder sind es am Ende nur die Herstellungskosten?“ Um für Unternehmen einen Anreiz zu schaffen, überhaupt in den Bereich und Forschung zu investieren, gewährt das Patentrecht ein Exklusivrecht. Ein wirksamer Patentschutz ist unabdingbar für Innovation, ohne Aussicht auf die zeitlich begrenzte Monopolstellung würde wohl kaum ein Unternehmen die hohen Investitionen tätigen. Dabei hat diese Monopolstellung schon früh eine Kehrseite: „Jede Patentanmeldung wird eineinhalb Jahre nach der Anmeldung in der Patentschrift veröffentlicht, unabhängig davon, ob es zur Eintragung kommt“, sagt Wipper. „Das heißt, andere können sich das ansehen und die eigene Forschung daran ausrichten.“ Die Rechtsanwältin berichtet von einem Trend, dass insbesondere im Pharmabereich deshalb immer weniger Patente angemeldet werden und stattdessen Wirkstoffe als Geschäftsgeheimnis geschützt werden.

„Das Spannungsfeld ergibt sich daraus, dass Patentrechte genau wie Markenrechte Exklusivitätsrechte sind.“
Dr. Anna-Kristine Wipper,
Partnerin und Head of IP-Law, KPMG Law Rechtsanwaltsgesellschaft.
Verlängerungstaktiken
Spätestens wenn der Patentschutz abgelaufen ist, treten die Generikahersteller auf den Plan. Sie möchten mit ihren Nachahmerpräparaten in den Wettbewerb einsteigen. Insbesondere für die Gesundheitssysteme und Patientinnen und Patienten ist das ein erfreulicher nächster Schritt: Eine im Auftrag der Europäischen Kommission erstellte Marktstudie hat ergeben, dass die Preise von Originalarzneimitteln in der Zeit nach der Markteinführung von Generika im Durchschnitt um 40 Prozent fallen und dass der Preis von Generika im Durchschnitt 50 Prozent unter dem ursprünglichen Preis des Originalpräparats liegt. Bei Blockbuster-Medikamenten können die Preissenkungen sogar noch drastischer ausfallen und erreichen bis zu 90 Prozent. „Ein wirksamer Wettbewerb durch Generika ist in der Regel der wichtigste Antrieb für den Preiswettbewerb auf den Arzneimittelmärkten und führt zu einem erheblichen Preisrückgang“, bestätigt Arianna Podesta, Kommissionssprecherin für Wettbewerb und Eurostat bei der Europäischen Kommission. Sie sieht den Forschungsaspekt auch unter einem etwas anderen Gesichtspunkt: „Der Markteintritt von Generika beendet die Marktexklusivität eines Originalpräparateherstellers und schafft Anreize für Pharmaunternehmen, sich für Innovationen zu engagieren.“ Das System kann nur funktionieren, wenn zwischen dem Schutz der Rechte an geistigem Eigentum und einem fairen und gesunden Wettbewerb ein Gleichgewicht besteht. Manche Patentinhaber versuchen indes, den Schutz mit unterschiedlichen Maßnahmen künstlich zu verlängern. Wie die Europäische Kommission mitteilt, erhält sie regelmäßig Beschwerden über den Missbrauch von Patenten sowie über Verleumdungskampagnen. Aktuell laufen Ermittlungen gegen Teva, Vifor Pharma und gemeinsam mit der Schweizer Wettbewerbskommission gegen ein Unternehmen im Bereich der dermatologischen Behandlungen. „Es handelt sich nicht um ein neues Phänomen“, berichtet Podesta. „Bereits im Rahmen einer Sektoruntersuchung in den Jahren 2008 und 2009 hat die Kommission verschiedene Patentierungs-, sowie Marketing- und Werbestrategien als Instrumente identifiziert, die von Originalpräparateherstellern regelmäßig eingesetzt werden, um den Markteintritt von Generikakonkurrenten zu verhindern oder zu behindern.“ Auch nationale Wettbewerbsbehörden sind immer wieder mit diesen Praktiken beschäftigt. Ein Beispiel nennt Gerrit Rixen, Partner und Head of Antitrust Law bei der KPMG Law Rechtsanwaltsgesellschaft: „Bevor sich ein Patentinhaber und ein anderes Unternehmen – in diesem Fall ein Generikahersteller – in einem jahrelangen und kostenintensiven Streit auseinandersetzen, streben sie Vergleichsverhandlungen an, die das Verhältnis einvernehmlich regeln sollen.“ Wenn solche Abreden den Wettbewerb beschränken, kommt das Kartellrecht zum Zuge. „Im Nachgang der Sektoruntersuchung im Bereich der Generika hat es einige Verfahren gegeben, denen der Vorwurf des sogenannten ‚Pay for Delay‘ zugrunde lag“, fährt Rixen fort. „Ein potenzieller Wettbewerber bekommt Geld und oder andere Vergünstigungen, dafür drängt er – zumindest vorerst – nicht mit seinen Produkten auf den Markt.“

„Weder das Patentrecht, noch das Kartellrecht sind losgelöste Rechtsgebiete. Sie greifen ineinander und das Kartellrecht greift in Missbrauchsfällen regulierend ein.“
Gerrit Rixen,
Partner, KPMG Law Rechtsanwaltsgesellschaft.
Kartellrechtliche Beurteilung
Ob eine kartellrechtlich relevante Patentvergleichsvereinbarung vorliegt, richtet sich nach dem sogenannten Kartellverbot; dies enthält auf europäischer Ebene Artikel 101 des Vertrages über die Arbeitsweise der Europäischen Union (AEUV)). „Dieser erfasst zunächst jegliche Vereinbarungen zwischen mehreren Unternehmen, die den Wettbewerb beschränken“, konkretisiert Rixen. In diesem Zusammenhang ist es nicht erforderlich, dass ein Unternehmen marktbeherrschend ist. Das spielt nur eine Rolle, wenn ein einseitiges Verhalten eines Unternehmens vorliegt. Das fällt in den Anwendungsbereich des sogenannten Missbrauchsverbotes. Dies regelt auf europäischer Ebene Artikel 102 AEUV. Auf diesem Gebiet ermittelt die Europäische Kommission derzeit gegen den global tätigen Pharmakonzern Teva mit Sitz in Israel, das über mehrere Tochtergesellschaften im Europäischen Wirtschaftsraum tätig ist, darunter auch in Deutschland. Im Februar 2015 war dessen Grundpatent für Glatirameracetat abgelaufen und damit der Patentschutz für das Multiple-Sklerose-Medikament Copaxone. Mitte Oktober des vergangenen Jahres stellte die Europäische Kommission vorläufig fest, dass Teva nach dem Auslaufen des Basispatents den Basispatentschutz für Glatirameracetat künstlich verlängert hat, indem es sekundäre Patentanmeldungen einreichte und wieder zurückzog und so seine Wettbewerber zwang, jedes Mal neue langwierige Rechtsmittel einzulegen. Nach Ermittlungen im Jahr 2019 eröffnete die Kommission im März 2021 ein förmliches Verfahren gegen Teva. „Sekundärpatentanträge greifen etwas Vorhandenes auf, das nicht neu ist und damit bereits als ‚Stand der Technik‘ eingestuft ist“, erklärt IP-Rechtsspezialistin Anna-Kristine Wipper. „Sie werden ergänzt durch neue Bestandteile, ein Sekundärpatent ist also praktisch ein Verbesserungspatent.“ In dem Fall stellt sich die Frage: Reicht das aus, um eine neuerliche Eintragung zu erlangen? Möglicherweise kommt es zur Beanstandung, zu Schriftverkehr. Darüber können Jahre ins Land ziehen. Ihr Kollege Gerrit Rixen weist auf die enorme Komplexität der Fälle hin und auf die Tragweite mit erheblichen finanziellen Folgen und Auswirkungen in einem höchst sensiblen Bereich, dem Gesundheitssektor. „Jedenfalls zögern in dieser Zeitspanne Generikahersteller, mit ihrem Produkt auf den Markt zu gehen – beziehungsweise: sie scheuen bereits die Investitionen. Sollten sie auf den Markt gehen und der ursprüngliche Patentinhaber erhält eine neue Eintragung, riskieren sie einstweilige Verfügungen oder ein Unterlassungsurteil.“ Die Rechtsunsicherheit wird noch dadurch verstärkt, dass die Beurteilung international unterschiedlich ausfallen kann. „Es kann sein, dass das amerikanische Patent Office eine Neuheit anerkennt und das Deutsche Patentamt nicht“, so Wipper. Mit dieser Rechtsunsicherheit lässt sich gewissermaßen spielen. „Einerseits ist der Schutz des Patentinhabers vollkommen berechtigt, damit er über sein geistiges Eigentum verfügen kann. Er muss Möglichkeiten haben, Schritte einzuleiten, und sich zu wehren können. Andererseits sollte es ein Unternehmen nach 20 Jahren auch geschafft haben, hinreichenden finanziellen Gewinn aus der Sache zu ziehen, so dass die freie Zugänglichkeit des Wirkstoffes regelmäßig kein Problem mehr darstellen sollte“, ergänzt Kartellrechtler Rixen.
Verwirrungstaktiken
Im Fall Teva steht noch ein zweiter Vorwurf im Raum. Die Europäische -Kommission stellte nämlich ebenfalls vorläufig fest, dass der Pharmakonzern eine systematische Diskreditierungskampagne durchgeführt hat, um die Verwendung von konkurrierenden Glatirameracetat-Produkten in unzulässiger Weise zu behindern. „Die Kommission hat Hinweise darauf, dass die Kampagne von Teva, die sich in erster Linie an Angehörige der Gesundheitsberufe richtet, möglicherweise auf konkurrierende Produkte abzielte, um einen falschen Eindruck von Gesundheitsrisiken zu erwecken, die mit deren Verwendung verbunden sind, selbst nachdem diese Arzneimittel von den zuständigen Gesundheitsbehörden zugelassen worden waren“, sagt Kommissionssprecherin Arianna Podesta. Teva selbst bedauert, dass die Europäische Kommission beschlossen hat, das Verfahren fortzusetzen. „Wir haben versucht, die Kommission davon zu überzeugen, dass ihre vorläufige Auffassung falsch ist“, betont eine Unternehmenssprecherin. Sie kündigt an, dass Teva weiterhin mit der Europäischen Kommission an einer Lösung der Angelegenheit arbeiten wird. Sie macht aber auch unmissverständlich klar: „Wir sind auch bereit, falls erforderlich, alle Anschuldigungen, die sich aus der Untersuchung der Europäischen Kommission ergeben, mit allen uns zur Verfügung stehenden rechtlichen und anderen Verfahrensrechten anzufechten. Wir bleiben der Rechtmäßigkeit unserer Geschäftstätigkeit und unserer Aufgabe, täglich Millionen von Menschen mit zugänglichen Arzneimitteln zu versorgen, uneingeschränkt verpflichtet.“ Die Untersuchung halte Teva nicht davon ab, Copaxone-Patienten, die mit Multiple Sklerose leben, sowie deren Familien zu unterstützen. Eine endgültige Entscheidung des Falles steht noch aus und sowohl Ergebnis als auch Argumentation werden mit Spannung erwartet.
Alexander Pradka

„Der Markteintritt von Generika beendet die Marktexklusivität eines Originalpräparateherstellers und schafft Anreize für Pharmaunternehmen, sich für Innovationen zu engagieren.“
Arianna Podesta,
Kommissionssprecherin für Wettbewerb und Eurostat, Europäische Kommission.
Verfahrensrecht
Die EuropäischeKommission sammelt ständig Informationen über die Arzneimittelmärkte und erhält Informationen oder Beschwerden von verschiedenen Interessengruppen. Nach einer Bewertung dieser Informationen kann die Kommission entscheiden, dass ein Fall eine weitere Untersuchung verdient. Sie kann eine Reihe von Ermittlungsinstrumenten einsetzen, darunter unangekündigte Nachprüfungen vor Ort, Auskunftsersuchen und Befragungen, und schließlich die Einleitung eines förmlichen Verfahrens beschließen. Beabsichtigt die Kommission nach einer eingehenden Untersuchung, eine Entscheidung zu erlassen, in der ein Verstoß gegen Artikel 101 und/oder 102 Vertrages über die Arbeitsweise in der Europäischen Union (AEUV) festgestellt wird, erlässt sie eine Mitteilung der Beschwerdepunkte, in der sie ihre vorläufige Beurteilung des Falles darlegt. Weder die Einleitung des Verfahrens noch die Mitteilung der Beschwerdepunkte greifen der Feststellung einer Zuwiderhandlung vor. Die Verfahrensbeteiligten bekommen Gelegenheit, sich zu den beanstandeten Punkten zu äußern. Das untersuchte Unternehmen kann sich gegen die Beschwerdepunkte im Verfahren bei der Kommission, und, falls dies erfolglos bleibt, vor den EU-Gerichten verteidigen. Es kann aber auch mit der Kommission zusammenarbeiten und sein Verhalten anpassen, indem es beispielsweise förmliche Verpflichtungen anbietet, um Bedenken der Kommission auszuräumen. Zur Feststellung der Zuwiderhandlung kommt es erst, wenn alle erforderlichen Verfahrensschritte durchgeführt wurden, so dass die Kommission ihre Bewertung abschließen und eine fundierte Entscheidung treffen kann.